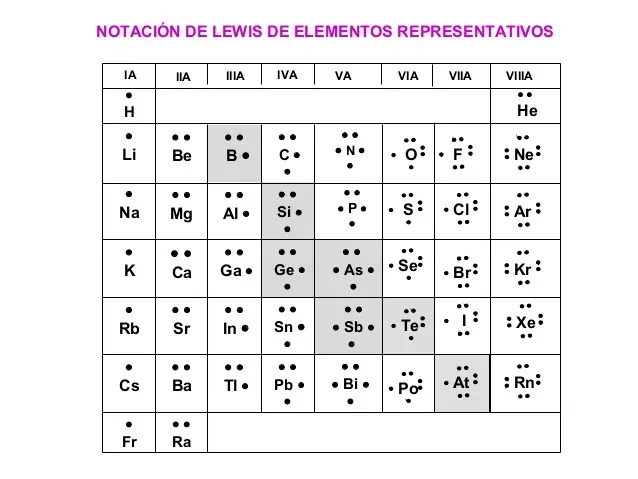
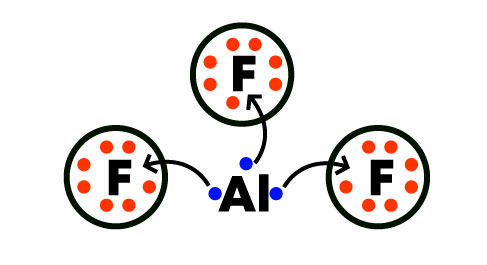
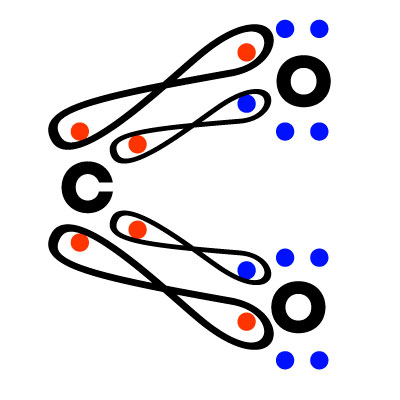
Muestra con exactitud la relación entre los átomos que forman la molécula. E múltiplo de la formula empírica por lo tanto se puede determinar, conociendo el peso molecular del compuesto y el peso de la formula mínima.
La fórmula empírica o formula condensada indica la relación proporcional entre el número de átomos de cada elemento presentes en la molécula, sin que esta relación señale exactamente la cantidad de átomos.
*Primer paso vamos a sacar la masa (m)
2×12=24 (2 Carbono x 12 (Masa del elemento))
4×1=4 (4 Hidrógeno x 1 (Masa del elemento))
1×35.5=35.5 (1 Cloro x 35.5 (Masa del elemento))
m=12+1+35.5
m=63.5
*Paso 2. Dividir la masa de 127g entre “m”
127÷ 63.5= 2
*Paso 3. Para sacar la fórmula molecular, vamos a multiplicar la fórmula empírica por 2
C2H4Cl x 2 = C4H8Cl2
Formula molecular= C4H8Cl2
Nomenclatura sistemática: 2,2-diclorobutano
*Paso1. Encontrar la fórmula empírica. Dividimos los porcentajes entre la masa molecular de cada elemento.
C: 92.3% ÷ 12= 7.69 mol
H: 7.7% ÷ 1= 7.7 mol
*Paso 2. Dividimos los resultados entre el número más pequeño de los mismos y redondeamos los resultados.
7.7÷ 7.69=1
7.69÷ 7.69=1
*Paso 3. Tomamos los valores y conformamos la fórmula empírica
Fórmula empírica= C1H1 o lo que es lo mismo CH
*Paso 4. Hallamos la masa empírica. Sumamos la masa del Carbono más la masa del Hidrógeno.
12 + 1= 13 g/mol
Masa empírica= 13 g/mol
*Paso 5. Hallamos la fórmula molecular. Fórmula: (masa empírica)n= masa molecular
(13)n=78
n=78/13
n=6
*Paso 6 Hallamos la fórmula molecular. Fórmula: (Fórmula empírica)n= Fórmula molecular
(CH)6=C6H6
Fórmula molecular= C6H6
Nomenclatura: Benceno
*Paso 1. Encontrar la fórmula empírica. Dividimos los porcentajes entre la masa molecular de cada elemento.
Na: 62% ÷ 23= 2.7 mol
O: 10% ÷ 16= 0.62 mol
*Paso 2. Dividimos los resultados entre el número más pequeño de los mismos y redondeamos los resultados.
2.7÷ 0.62=4
0.62÷ 0.62=1
*Paso 3 Tomamos los valores y conformamos la fórmula empírica
Fórmula empírica= Na40
*Paso 4. Hallamos la masa empírica. Sumamos la masa del Na más la masa del O.
23 + 16= 39 g/mol
Masa empírica= 39 g/mol
*Paso 5. Hallamos la fórmula molecular. Fórmula: (masa empírica)n= masa molecular
(39)n=120
n=120/39
n=3
*Paso 6 Hallamos la fórmula molecular. Fórmula: (Fórmula empírica)n= Fórmula molecular
(Na40)3= Na1203
Fórmula molecular= Na1203
*Paso 1. Encontrar la fórmula empírica. Dividimos los porcentajes entre la masa molecular de cada elemento.
C: 33.5% ÷ 12= 2.8 mol
H: 5% ÷ 1= 5 mol
*Paso 2. Dividimos los resultados entre el número más pequeño de los mismos y redondeamos los resultados.
2.8÷ 2.8=1
5÷ 2.8=2.
*Paso 3. Tomamos los valores y conformamos la fórmula empírica
Fórmula empírica= CH2
*Paso 4. Hallamos la masa empírica. Sumamos la masa del C más la masa del H.
12+ 1= 13 g/mol
Masa empírica= 13 g/mol
*Paso 5. Hallamos la fórmula molecular. Fórmula: (masa empírica)n= masa molecular
(13)n=67
n=67/13
n=5
*Paso 6. Hallamos la fórmula molecular. Fórmula: (Fórmula empírica)n= Fórmula molecular
(CH2)5= C5H10
Fórmula molecular= C5H10
Nomenclatura: Ciclopentano
*Paso 1. Encontrar la fórmula empírica. Dividimos los porcentajes entre la masa molecular de cada elemento.
N: 73% ÷ 14= 5.2 mol
H: 15% ÷ 1= 15 mol
*Paso 2. Dividimos los resultados entre el número más pequeño de los mismos y redondeamos los resultados.
5.2÷ 5.2=1
15÷ 5.2=3.
*Paso 3. Tomamos los valores y conformamos la fórmula empírica
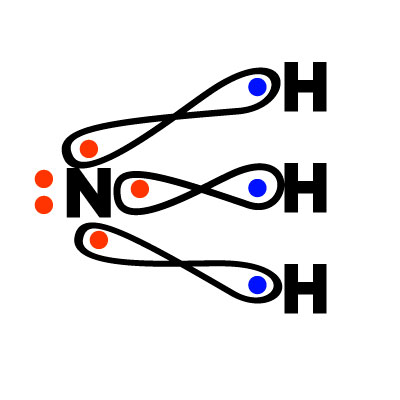
Fórmula empírica= NH3
*Paso 4. Hallamos la masa empírica. Sumamos la masa del C más la masa del H.
14+ 1= 15 g/mol
Masa empírica= 15 g/mol
*Paso 5. Hallamos la fórmula molecular. Fórmula: (masa empírica)n= masa molecular
(15)n=120
n=120/15
n=8
*Paso 6. Hallamos la fórmula molecular. Fórmula: (Fórmula empírica)n= Fórmula molecular
(NH3)8= N8H27
Fórmula molecular= N8H27