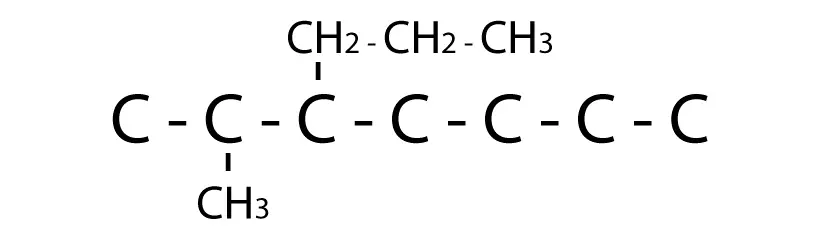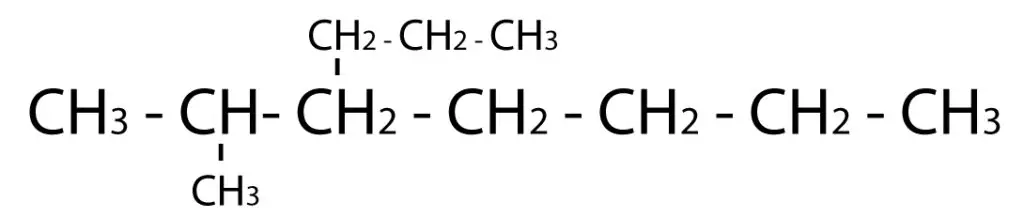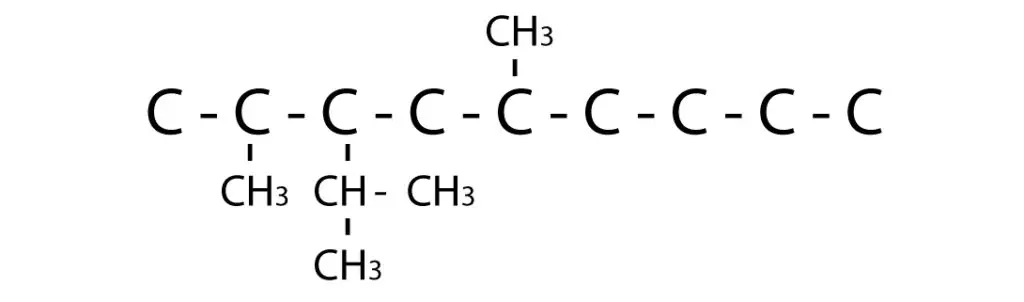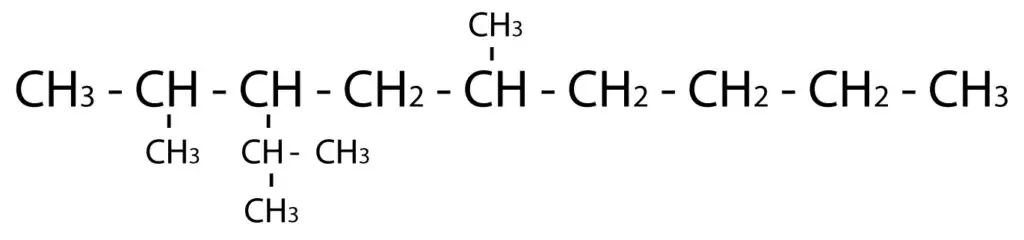Las reacciones de eliminación son un tipo de reacción química en la cual una molécula pierde átomos o grupos funcionales para formar una molécula más simple. Uno de los ejemplos más comunes de reacciones de eliminación es la eliminación de un grupo o átomo de hidrógeno y un grupo funcional, como un halógeno, de una molécula orgánica. Aquí tienes algunos ejemplos de reacciones de eliminación:
- Reacción de eliminación de haloalcanos: En esta reacción, un haloalcano (compuesto orgánico que contiene un átomo de halógeno) pierde un átomo de hidrógeno y un átomo de halógeno para formar un alqueno. Por ejemplo:CH3CH2CH2Cl (1-cloropropano) → CH2=CHCH3 (propeno) + HCl
- Reacción de eliminación en la síntesis de alquilos dobles o triples: En esta reacción, un compuesto orgánico que contiene grupos funcionales alquilo (grupos alquilo unidos por un enlace doble o triple) se somete a una eliminación para formar un alqueno o alquino. Por ejemplo:CH3CH2CH2CH2Br (1-bromobutano) → CH3CH=CHCH3 (buteno) + HBr
- Desalquilación: En la desalquilación, un compuesto orgánico con un grupo alquilo pierde un grupo alquilo más pequeño, generalmente un grupo metilo (-CH3), para formar una molécula más pequeña. Por ejemplo:CH3CH2CH2CH3 (butano) → CH3CH2CH=CH2 (buteno) + CH4
- Eliminación de agua (deshidratación): En esta reacción, una molécula de agua se elimina de una molécula orgánica para formar un doble enlace en su lugar. Por ejemplo:CH3CH2CH2OH (alcohol etílico) → CH2=CH2 + H2O
- Eliminación de dióxido de carbono: En algunas reacciones, el dióxido de carbono se elimina de una molécula orgánica, formando una estructura más simple. Por ejemplo:CO2CH3 (ácido acético) → CH3CHO (acetaldehído) + CO2
Estos son ejemplos de reacciones de eliminación en química orgánica. Estas reacciones son fundamentales para la síntesis de una amplia variedad de compuestos orgánicos y desempeñan un papel importante en la química orgánica sintética.