¿Qué es la sustitución simple?
Es una reacción, en la cual un elemento es sustituido por otro dentro de un compuesto.
Metal + Ácido -> Sal + Hidrógeno
Metal + Sal Haloidea -> Sal + Metal
Ejemplos de reacciones de desplazamiento simple
1. Al + HCl ->
Paso 1. El metal y el no metal se juntan.
Al + HCl -> AlCl
Paso 2. Pasamos el Hidrógeno solo (siempre que el hidrógeno quede solo, este debe de tener 2 átomos).
Al + HCl -> AlCl + H2
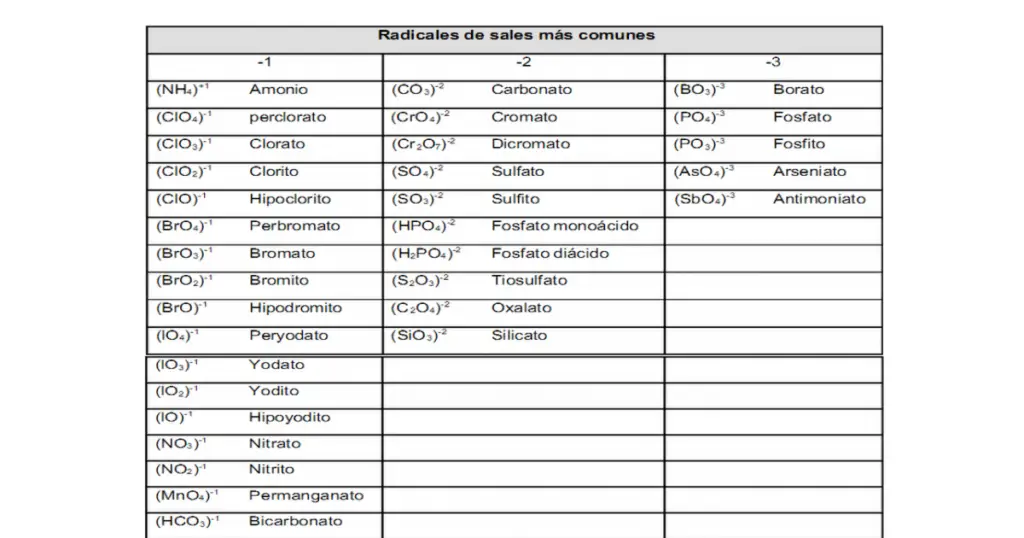
Paso 3. El compuesto que quedó como la sal, utilizando el formulario de número de oxidación, vas a localizar los números de valencia u oxidación de estos dos elementos Al y Cl.
Al + HCl -> Al+3Cl-1 + H2
Paso 4. Los números de oxidación se cruzan.
Al + HCl -> AlCl3 + H2
Paso 5. Balanceamos la ecuación
R= 2Al + 6HCl -> 2AlCl3 + 3H2
2. Mg + H3P ->
Paso 1. El metal y el no metal se juntan.
Mg + H3P -> Mg P
Paso 2. Pasamos el Hidrógeno solo (siempre que el hidrógeno quede solo, este debe de tener 2 átomos).
Mg + H3P -> Mg P + H2
Paso 3. El compuesto que quedó como la sal, utilizando el formulario de número de oxidación, vas a localizar los números de valencia u oxidación de estos dos elementos Mg y P.
Mg + H3P -> Mg+2 P-3 + H2
Paso 4. Los números de oxidación se cruzan.
Mg + H3P -> Mg3P2 + H2
Paso 5. Balanceamos la ecuación
R= 3Mg + 2H3P -> Mg3P2 + 3H2
3. Fe + H2S ->
Paso 1. El metal y el no metal se juntan.
Fe + H2S -> Fe S
Paso 2. Pasamos el Hidrógeno solo (siempre que el hidrógeno quede solo, este debe de tener 2 átomos).
Fe + H2S -> Fe S + H2
Paso 3. El compuesto que quedó como la sal, utilizando el formulario de número de oxidación, vas a localizar los números de valencia u oxidación de estos dos elementos Fe y S.
Fe + H2S -> Fe+2 S-2 + H2
Paso 4. Los números de oxidación se cruzan.
Fe + H2S -> Fe2 S2 + H2
Paso 5. Balanceamos la ecuación
R= 2Fe + 2H2S -> Fe2 S2 + 2H2
4. Mg + NaCl ->
Paso 1. Juntamos los metales y pasamos el Na
Mg + NaCl -> MgCl + Na
Paso 2. Colocamos los números de oxidación con el formulario de oxidación.
Mg + NaCl -> Mg+2Cl-1 + Na
Paso 3. Cruzamos los números de oxidación.
Mg + NaCl -> MgCl2 + Na
Paso 4. Equilibramos la ecuación.
R= Mg + 2NaCl -> MgCl2 + 2Na
5. Ag + B2N3 ->
Paso 1.Intercambiamos los metales y pasamos el B
Ag + B2N3 -> AgN + B
Paso 2. Colocamos los números de oxidación con el formulario de oxidación.
Ag + B2N3 -> Ag+1N-3 + B
Paso 3. Cruzamos los números de oxidación.
Ag + B2N3 -> Ag3N+ B
Paso 4. Equilibramos la ecuación. R= 9Ag + B2N3 -> 3Ag3N+ 2B