Propiedades químicas
Una propiedad química de la materia es cualquiera que modifique su composición.
Ejemplos de propiedades químicas
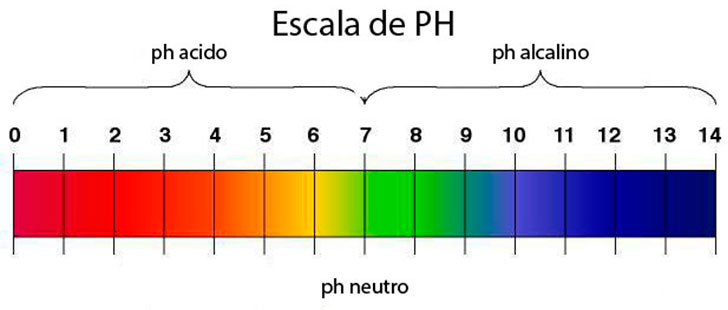
1. El ph
El ph indica el nivel de acidez o basicidad de una solución.
2. Poder calorífico
Es la cantidad de energía que puede liberar la materia al producirse una reacción química.
3. Reactividad
Mide la capacidad de reaccionar de una sustancia.
4. Conductibilidad eléctrica
Determina la capacidad de un material para dejar pasar la corriente eléctrica.
5. Ionización
Es un fenómeno químico, el cual genera iones (átomos o moléculas cargadas eléctricamente) gracias a la falta o exceso de electrones.
Propiedades Físicas
Es la propiedad que toma en cuenta la estructura del objeto, es decir, cualquier propiedad que es medible que no cambie la composición de la materia.
Ejemplos de propiedades físicas
1. Dureza
Es la cantidad de resistencia que opone un cuerpo al ser golpeado por otro.
2. Forma
El conjunto de líneas que delimitan a una superficie.
3. Tamaño
Determina las dimensiones físicas de un objeto.
4. maleabilidad
La maleabilidad mide la cantidad de elasticidad que tiene un cuerpo.
5. Densidad
Es una relación entre el volumen y la masa de un cuerpo.